Ácido hexafluorofosfórico
 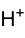  | ||
| Nombre IUPAC | ||
| hidrógeno hexafluorofosfato | ||
| General | ||
| Otros nombres | Ácido hexafluorofosfórico | |
| Fórmula semidesarrollada | HPF6 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 16940-81-1[1] | |
| InChI InChI=InChI=1S/F6P/c1-7(2,3,4,5)6/q-1/p+1 Key: LJQLCJWAZJINEB-UHFFFAOYSA-O | ||
| Propiedades físicas | ||
| Apariencia | líquido aceitoso incoloro | |
| Densidad | 1770 kg/m³; 1,77 g/cm³ | |
| Masa molar | 145,97 g/mol | |
| Peligrosidad | ||
| Frases R | R23/24/25 R34 | |
| Frases S | S4 S9 S20 S23 S26 S27 S36/37/39 S45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
[editar datos en Wikidata] | ||
El ácido hexafluorofosfórico es un compuesto inorgánico de fórmula química HPF6. El producto comercial es una solución de 60-70%.
Es un ácido fuerte de Brønsted incluye un anión no coordinante, hexafluorofosfato ( PF6-).
Síntesis
Se forma a partir de la reacción del fluoruro de hidrógeno con pentafluoruro de fósforo.[2]
También se pueden preparar por reacción de ácido fosfórico o pentóxido de fósforo con fluoruro de hidrógeno o ácido fosfórico con fluoruro de calcio y ácido sulfúrico.[3]
Propiedades
Al igual que muchos ácidos fuertes, el ácido hexafluorofosfórico no es aislable sólo es estable en solución. La solución acuosa es incolora, ácida ( ácido Brønsted ) y puede llegar hasta una concentración de aproximadamente 75% se concentra. Sus soluciones acuosas consisten de iones hidronio, H6O+ y PF6−. Además, dichas soluciones contienen productos derivados de la hidrólisis de los enlaces PF, incluyendo HPO2F2, H2PO2F , y H3PO4, y sus bases conjugadas.[4]
El ácido hexafluorofosfórico se descomponen a temperaturas elevadas y libera fluoruro de hidrógeno.[5]
El hexahidrato recibe el nombre de "hexafluoro cristalino", el ion PF6− está encerrado en jaulas octaédricos truncadas, formado por agua y protones. La espectroscopia de resonancia magnética nuclear proporciona evidencia de que estas soluciones de hexahidrato contienen cantidades significativas de fluoruro de hidrógeno.[4]
Aplicación
- El hexafluorofosfórico se emplea como catalizador en la fotopolimerización.[5]
- Las sales de hexafluorofosfórico se utilizan en líquidos iónicos.[6]
Referencias
- ↑ Número CAS
- ↑ Arpad Molnar; G. K. Surya Prakash; Jean Sommer (2009). Superacid Chemistry (2nd edición). Wiley-Interscience. p. 44. ISBN 0-471-59668-X.
- ↑ Herstellung von Hexafluorophosphorsäure
- ↑ a b D. W. Davidson; S. K. Garg (mayo de 1972). «The Hydrate of Hexafluorophosphoric Acid». Canadian Journal of Chemistry 50: 3515-3520. doi:10.1139/v72-565.
- ↑ a b Entrada CAS. 16940-81-1 en la base de datos GESTIS del IFA.
- ↑ Journal of Physical Chemistry, 2002, 106 (29), pp 7315–7320
 Datos: Q418824
Datos: Q418824














