Pila de limón
- Si está buscando instrucciones sobre como construir una batería de limón para usar con una bombilla led, vea
 Lemon Battery en Wikibooks.
Lemon Battery en Wikibooks.
| Pila de limón | ||
|---|---|---|
| Ánodo | Zinc | |
| Cátodo | Cobre | |
| Electrolito | Ácido (ácido cítrico) | |
[editar datos en Wikidata] | ||
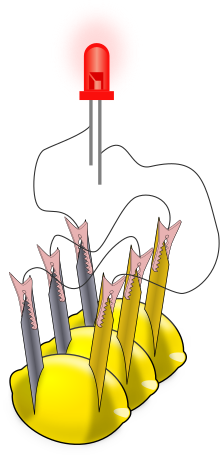
La pila de limón es un experimento propuesto como proyecto en muchos libros de texto de ciencias. Consiste en insertar, en un limón, dos objetos hechos de metales diferentes, por ejemplo un clavo galvanizado de zinc (también denominado cincado) y una moneda o clavo de cobre (también es posible con un clavo de hierro). Estos dos objetos funcionan como electrodos, causando una reacción electroquímica mediante el jugo de limón que genera una pequeña cantidad de corriente eléctrica.
El objetivo de este experimento es demostrar a los estudiantes cómo funcionan las baterías. Después de que la pila está ensamblada, se puede usar un multímetro para comprobar el voltaje generado, que usualmente no supera 1 V y una corriente de aproximadamente 0,1 mA como máximo.[1] El voltaje y corriente producido es insuficiente para encender un led estándar, para lo que se requeriría una batería hecha de varias pilas de limón. Se necesitan al menos dos pilas conectadas en serie para duplicar el voltaje y varias conectadas en paralelo para alcanzar corrientes del orden de 5 mA. De esta forma, se puede encender un diodo led de bajo voltaje (aproximadamente dos o tres voltios).
Reacciones químicas
Una pila eléctrica es un dispositivo que convierte energía química en energía eléctrica por un proceso químico transitorio, tras lo cual cesa su actividad y han de renovarse sus elementos constituyentes, puesto que sus características resultan alteradas durante el mismo. Se trata de un generador primario. Esta energía resulta accesible mediante dos terminales que tiene la pila, llamados polos, electrodos o bornes. Uno de ellos es el polo negativo o cátodo y el otro es el polo positivo o ánodo.
La estructura fundamental de una pila consiste en dos electrodos, metálicos en muchos casos, introducidos en una disolución conductora de la electricidad o electrolito.[cita requerida]
Técnicamente ocurren la oxidación y la reducción. [2]
En el ánodo, el zinc es oxidado: zinc
En el cátodo, se reducen los iones de hidrógeno presentes en el zumo del limon:
- 2 H++ 2 e- → H2
Para medir los voltajes e intensidades, se conecta la punta del polímetro que va al polo positivo (+) al cobre (punta roja) y al zinc la otra punta del polímetro (punta negra) que va al polo negativo (-). El electrodo de zinc es una fuente de electrones.[3]
La tensión y la intensidad alcanzadas dependen de la acidez de los limones y del tamaño y del metal de los objetos usados.
Metales

Otras combinaciones de metales (como magnesio y cobre) son más eficientes, pero generalmente se emplean zinc y cobre porque son razonablemente seguros y fáciles de obtener.
Usar una tira de magnesio en vez del zinc debe duplicar, aproximadamente, la corriente producida en la celda de limón (aproximadamente 240 µA con zinc y cerca de 400 µA con magnesio) y también aumenta levemente la tensión (0,97 V con zinc y 1,6 V con magnesio).
Otras frutas y vegetales

Una alternativa común a los limones es la papa o a veces manzanas. Puede usarse cualquier fruta o vegetal que contenga ácido, almidón u otro electrolito, pero se prefieren los limones debido a su mayor acidez.
Diodo led
En términos generales, pueden considerarse de forma aproximada los siguientes valores de voltaje para los diodos led:[4]
- Rojo = 1,8 a 2,2 voltios.
- Anaranjado = 2,1 a 2,2 voltios.
- Amarillo = 2,1 a 2,4 voltios.
- Verde = 2 a 3,5 voltios.
- Azul = 3,5 a 3,8 voltios.
- Blanco = 3,6 voltios.
La Intensidad de corriente está comprendida entre 10 y 20 mA.[5]
Para alargar la vida de los led´s (y de todos los componentes en general), se pueden seguir algunos consejos:[5]
- No hacerlos trabajar al límite. Si un LED indica que permite un paso de corriente de máximo 20 mA, es una buena práctica no exceder el límite de 15 mA.
- Así mismo, a más voltaje más luz darán, pero también se calentarán más y su vida durará menos.
Véase también
- Alessandro Volta
- Batería de céntimoen
- Hilo conductor
- Pila alcalina
- Pila casera.
- Pila Daniell
- Pila galvánica
- Pila salina
- Vinagre.
Referencias
- ↑ http://www.thenakedscientists.com/HTML/content/kitchenscience/exp/charging-ipods-with-lemons/
- ↑ «http://divulgadores.com/la-pila-de-limon/». Consultado el 27 de abril de 2015.
- ↑ http://teleformacion.edu.aytolacoruna.es/FISICA/document/fisicaInteractiva/sacaleE_M2/Volta/PilaLimonCuZn.htm
- ↑ «LED Color Chart», artículo en el sitio web OkSolar del 10 de julio de 2000. Consultado el 18 de abril de 2008.
- ↑ a b http://rduinostar.com/documentacion/componentes/el-diodo-led/
Enlaces externos
- Batería con limones, Electrotecnia
- Lemon Battery, Hila Research Center
- The Lemon Battery Challenge Archivado el 23 de septiembre de 2010 en Wayback Machine., National Engineers Week
- D.J. Swartling, C. Morgan (1998). Lemon Cells Revisited—The Lemon-Powered Calculator. Journal of Chemical Education, 75 (2), page 181.
- Lemon battery explained (en inglés)
- Sacar electricidad de las patatas
 Datos: Q3621156
Datos: Q3621156 Multimedia: Lemon batteries / Q3621156
Multimedia: Lemon batteries / Q3621156
]












