Tagatose
| Tagatose | |
 | |
| Structure linéaire du D-(–)-Tagatose & L-(+)-Tagatose | |
| Identification | |
|---|---|
| Nom UICPA | (3S,4S,5R)-1,3,4,5,6- pentahydroxy-2-hexanon, (3R,4R,5S)-1,3,4,5,6-pentahydroxy-2-hexanon |
| Synonymes | D-lyxo-Hexulose |
| No CAS | 87-81-0 (D) 17598-82-2 (L) 17598-81-1 (DL) |
| No ECHA | 100.001.612 |
| No CE | 201-772-3 (D) |
| PubChem | 92092 |
| No E | E963 (D) |
| Apparence | Solide blanc |
| Propriétés chimiques | |
| Formule | C6H12O6 [Isomères] |
| Masse molaire[1] | 180,155 9 ± 0,007 4 g/mol C 40 %, H 6,71 %, O 53,29 %, |
| Propriétés physiques | |
| T° fusion | 134,5 °C[2] |
| Solubilité | Soluble dans l'eau. Faiblement soluble dans l'éthanol. |
| Précautions | |
| Directive 67/548/EEC | |
Phrases S : S24/25 : Éviter le contact avec la peau et les yeux. Phrases S : 24/25, | |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
Le tagatose (galactulose) est un cétohexose (un hexose du type cétose), c'est un ose constitué d’une chaîne de 5 éléments carbone ainsi que d’une fonction cétone.
Chimie
Le D-tagatose est un épimere du D-fructose en C-4. Sa formule chimique est C6H12O6.
Un désoxyose du tagatose est le fuculose.
Dans l'eau à 27 °C, la forme isomère prédominante du D-tagatose est la forme α-D-tagatopyranose (98 %)[3].
| Isomère du D-Tagatose | ||
|---|---|---|
| Forme linéaire | Projection de Haworth | |
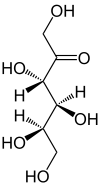 0,6 % |  α-D-Tagatofuranose 1 % |  ß-D-Tagatofuranose 4 % |
 α-D-Tagatopyranose 79 % |  ß-D-Tagatopyranose 16 % | |
Source
Le D-tagatose a été découvert par Gilbert Levin en 1926. Le tagatose est naturellement présent dans les produits laitiers sous sa configuration D.
Propriétés
- La digestion du tagatose par l'organisme diffère de celle du saccharose et a un effet moindre sur la concentration du glucose et de l'insuline dans le sang.
- Il apporte 38 % moins de calories que les autres sucres.
- C'est un sucre prébiotique[4].
- Son pouvoir sucrant est de 75-92 % comparé au sucre de table (à poids égal)[5].
Production
Le D-tagatose est produit en deux étapes à partir du lactose. Le lactose est hydrolysé enzymatiquement par l'aspergillus oryzae lactase, pour former dans un premier temps le D-galactose. Ce dernier est ensuite isomérisé en présence de l'hydroxyde de calcium pour former le D-tagatose, après purification, neutralisation, chromatographie échangeuse d'ions et recristallisation[5],[6].
Utilisation
Le tagatose est reconnu GRAS par la FAO/OMS depuis 2001[5]. Il est utilisé dans l'industrie alimentaire comme édulcorant, humectant, texturant, épaississant, agent de charge[6]. Son usage est limité à 1 % dans les boissons et de 10 à 60 % suivant les autres applications[5].
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) « Tagatose », sur ChemIDplus, consulté le 16 septembre 2009.
- ↑ (en) Peter M. Collins, Dictionary of carbohydrates, CRC Press, (réimpr. 2005), 1282 p. (ISBN 978-0-8493-3829-8 et 0-8493-3829-8).
- ↑ Marion Guerrero-Wyss, Samuel Durán Agüero et Lisse Angarita Dávila, « D-Tagatose Is a Promising Sweetener to Control Glycaemia: A New Functional Food », BioMed Research International, vol. 2018, (ISSN 2314-6133, PMID 29546070, PMCID PMC5818958, DOI 10.1155/2018/8718053, lire en ligne, consulté le )
- ↑ a b c et d (en) Agency Response Letter GRAS Notice No. GRN 000078.
- ↑ a et b (en) JECFA, WHO, « D-TAGATOSE », Monograph de la FAO, sur www.fao.org, (consulté le ), p. 1-2 [PDF].
Voir aussi
Articles connexes
Liens externes
- (en) D-Tagatose lyxo-Hexulose NCBI database
- (en) COMPOUND: C00795 D-Tagatose www.Genome.net
v · m | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Général | |||||||||||
| Géométrie | |||||||||||
| Oses |
| ||||||||||
| Oligosaccharides |
| ||||||||||
| Polysaccharides |
| ||||||||||
| Glycosaminoglycanes |
| ||||||||||
| Aminosides | |||||||||||
Grandes familles de biomolécules : | |||||||||||
 Portail de la chimie
Portail de la chimie  Portail de la biochimie
Portail de la biochimie













