Liên kết đôi
Liên kết đôi là liên kết hóa học giữa hai nguyên tử, được tạo bởi một liên kết sigma (hay liên kết đơn) và một liên kết pi. Liên kết đôi bền và khó phá vỡ hoàn toàn hơn liên kết đơn, nhưng lại dễ tham gia phản ứng hóa học hơn do chứa liên kết pi dễ bị phá vỡ hơn liên kết sigma.
Trong hóa học hữu cơ, liên kết đôi thường thấy trong liên kết giữa hai nguyên tử C (C=C) ở anken hay ankadien hoặc liên kết C=0 ở xeton.
- Các chất có liên kết đôi
-
 Liên kết C=O trong acetone
Liên kết C=O trong acetone -
 Liên kết C=C trong ethylene
Liên kết C=C trong ethylene -
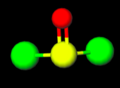 Liên kết S=O trong thionyl chloride
Liên kết S=O trong thionyl chloride -
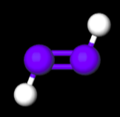 Liên kết N=N trong diazene
Liên kết N=N trong diazene -
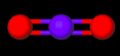 Liên kết N=O trong nitơ dioxide
Liên kết N=O trong nitơ dioxide
Tham khảo
- Pyykkö, Pekka; Riedel, Sebastian; Patzschke, Michael (2005). “Triple-Bond Covalent Radii”. Chemistry - A European Journal. 11 (12): 3511–20. doi:10.1002/chem.200401299. PMID 15832398.
Bài viết này vẫn còn sơ khai. Bạn có thể giúp Wikipedia mở rộng nội dung để bài được hoàn chỉnh hơn.
|















